
村上 晃規1,2,3,4、赤嶺 綸子1、村田 浩一2,5、西谷 江平2、伊藤 宣2,5,6、渡部
龍7、藤井 貴之2,5、岩﨑 毅8、増尾 優輝1、井利 宰1、中村
伸一郎2、栗山 新一2、森田 侑吾2、村川 泰裕3,9、寺尾 知可史10,11,12、岡田
随象13,14,15、橋本 求7、松田 秀一2、上野 英樹1,3,4、吉富 啓之1,3,4
1京都大学大学院医学研究科免疫細胞生物学
2京都大学大学院医学研究科整形外科学
3京都大学ヒト生物学高等研究拠点
4京都大学免疫モニタリングセンター
5京都大学大学院医学研究科リウマチ性疾患先進医療学
6倉敷中央病院整形外科
7大阪公立大学大学院医学研究科膠原病内科学
8京都大学大学院医学研究科附属ゲノム医学センター
9理化学研究所生命医科学研究センター理研-IFOMがんゲノミクス連携研究チーム
10理化学研究所生命医科学研究センターゲノム解析応用研究チーム
11静岡県立総合病院臨床研究部免疫研究部
12静岡県立大学薬学部ゲノム病態解析分野
13東京大学大学院医学系研究科遺伝情報学
14大阪大学大学院医学系研究科遺伝統計学
15理化学研究所生命医科学研究センターシステム遺伝学チーム

ヒト関節リウマチ(RA)においてCD4+ T細胞の炎症制御機構は十分に解明されていない。我々は、RA患者の滑膜・関節液のCD4+
T細胞に対しシングルセル解析を実施し、疾患活動性と相関する液性因子insulin-like growth factor like family member
2(IGFL2)を同定した。IGFL2はげっ歯類には存在しない霊長類特異的な液性因子で、CD4+
T細胞特異的に発現し、特にTph細胞で高発現していた。機能解析の結果、IGFL2はTph細胞におけるCXCL13産生や単球における炎症性マクロファージ関連遺伝子の発現を促進した。さらにCRISPR-Cas9によりIGFL2をノックアウトしたTph細胞は、単球の炎症性応答を抑制した。血清中IGFL2濃度はRAで上昇しており、IGFL2はRAにおける新規バイオマーカーおよび治療標的の候補となりうる。
論文キーワード:IGFL2、Tph細胞、関節リウマチ
著者コメント:
このたびは最優秀演題賞に選出いただき大変光栄に存じます。また本研究でご指導いただきました先生方に厚く御礼申し上げます。素晴らしい環境で多くの先生方と交流することができ、大変充実した学会となりました。今後は研究成果を臨床に結びつけられるように研究を進めてまいりたいと思います。
吉富 啓之1,8、増尾 優輝1、村上 晃規1,2、赤嶺 綸子1、井利 宰1、宇野 俊輔1、村田
浩一3、西谷 江平1、伊藤 宣4、渡部 龍5、藤井 貴之3、岩﨑 毅6、村川
泰裕7,8、寺尾 知可史9、岡田 随象10,11,12、橋本 求5、松田 秀一2、上野
英樹1,8
1京都大学大学院医学研究科 免疫細胞生物学
2京都大学大学院医学研究科 整形外科
3京都大学医学部附属病院 リウマチセンター
4倉敷中央病院 整形外科
5大阪公立大学大学院医学研究科 膠原病内科
6京都大学大学院医学研究科 附属ゲノム医学センター 疾患ゲノム疫学
7理化学研究所 生命医科学研究センター 理研-IFOMがんゲノミクス連携研究チーム
8京都大学ヒト生物学高等研究拠点
9理化学研究所 生命医科学研究センター ゲノム解析応用研究チーム
10大阪大学大学院医学系研究科 遺伝統計学
11理化学研究所 生命医科学研究センター システム遺伝学チーム
12東京大学大学院医学系研究科 分子生物学講座

関節リウマチ(RA)病態に関わるCD4分画としてTph細胞が報告されているが、RA滑膜おけるこれらの動態は明らかでない。我々はRA滑膜検体に対しシングルセル解析、空間的RNA解析、in
vitro検証によるマルチモーダルな解析を行い、Tph細胞には機能的・空間的に異なった幹細胞様Tph(S-Tph)細胞とエフェクターTph(E-Tph)細胞が存在することを示した。S-Tph細胞は自己複製的な高い増殖能を示すとともに、三次リンパ濾胞(TLS)においてB細胞と共在していた。この共存によりB細胞分化が生じるとともに、S-TphからE-Tphへの一方向性分化が生じた。E-Tph細胞は分化に伴いケモカイン受容体の発現パターンを変えTLS外においてB細胞ではなくマクロファージと共在していた。この様にS-Tph細胞は滑膜におけるTph細胞の維持に関わるとともにE-Tph細胞の分化にも関与し、RAの新たな治療標的として期待される。
論文キーワード:幹細胞様Tph細胞、三次リンパ構造、関節リウマチ
著者コメント:
この度は栄誉ある賞ならびに発表の機会をいただき心より感謝いたします。この発表は博士課程の増尾優輝氏の仕事です。骨免疫学会での3日間は開放的な環境で多くの先生方と刺激的な交流ができる素晴らしい3日間でした。このような機会を与えてくださった山岡会長ならびに関係者の皆様に深謝いたします。
小野 紗也加1、辻 直紀2,3、坂本 朋昭2、小口 修矢1、中村 貴4、星
和人1,2,3、疋田 温彦2,3
1東京大学医学部附属病院 口腔顎顔面外科・矯正歯科
2東京大学大学院医学系研究科 外科学専攻 感覚・運動機能医学講座 口腔顎顔面外科学
3東京大学医学部附属病院 ティッシュ・エンジニアリング部
4東京歯科大学 口腔科学研究センター

骨リモデリングを再現した機能性骨オルガノイドを用いて、システインプロテアーゼ阻害剤E-64の影響を窒素含有ビスホスホネートであるゾレドロン酸(ZOL)と比較した。コントロール群では骨吸収と骨形成に空間的・量的相関が見られ、両者のカップリングが示唆された。ZOL群では吸収・形成ともに著しく抑制され、カップリングの減弱が認められた。一方、E-64群では吸収・形成の減少は軽度だったが、カップリングは消失し、吸収窩で見られた球形度の高い骨芽細胞の出現も抑制された。これらの細胞は骨吸収期から骨形成期への移行を促すreversal
cellであることが示唆され、その出現の阻害がカップリング消失に関与している可能性がある。以上より、カテプシンKを含むシステインプロテアーゼ阻害が骨リモデリングの細胞動態に特異的な影響を与えることが示唆され、新たな骨粗鬆症治療法の開発に貢献する可能性がある。
論文キーワード:破骨細胞、骨代謝、骨リモデリング
著者コメント:
この度は第10回日本骨免疫学会において最優秀演題賞を賜り、大変光栄に存じます。本研究は、機能性骨オルガノイドを用いた骨リモデリング機構の解明を目指したものであり、今後の骨粗鬆症治療の新たな可能性につながることを期待しております。ご指導・ご助言を賜りました皆様に心より御礼申し上げます。
赤嶺 綸子1、村上 晃規1,2、増尾 優輝1、井利 宰1,3、上野 英樹1,4、吉富
啓之1,2
1京都大学大学院医学研究科 免疫細胞生物学教室
2京都大学医学部附属病院 整形外科
3京都大学大学院医学研究科 内科学講座 臨床免疫学
4京都大学高等研究院ヒト生物学高等研究拠点(ASHBi) 免疫グループ

関節リウマチ(RA)炎症滑膜には、三次リンパ構造(TLS)と呼ばれるリンパ球の集簇を認める。TLSを介したB細胞応答が病態に関わるとの仮説のもと、RA患者滑膜におけるB細胞の局在を調査する目的で、RA患者滑膜4検体にてXeniumによる空間的トランスクリプトーム解析を行った。
その結果、ナイーブB細胞、メモリーB細胞、AICDA陽性B細胞、CD11c陽性B細胞、形質細胞を含む様々な滑膜B細胞分画が同定された。TLS内にはCXCR5+
B細胞が、TLS辺縁にはCXCR5low B細胞が多くみられ、CXCR5の発現による局在の差異を認めた。CXCR5+ B細胞はTLS内でCXCL13を産生するTph細胞と強く隣接していたが、CXCR5low
B細胞が隣接する細胞には一定の傾向を認めなかった。
RA滑膜TLSでは、主にCXCR5+ B細胞とTph細胞が相互作用することで、抗体産生細胞が分化すると考えられる。
論文キーワード:関節リウマチ、B細胞、三次リンパ構造
著者コメント:
この度は貴重な発表の機会を賜り、そして最優秀演題賞を頂戴し大変光栄に存じます。骨免疫学会へは初めての参加でしたが、様々な分野のご発表を勉強させていただき、多くの研究者の先生方と交流させていただきとても刺激的な3日間でした。社会に還元できる研究に発展させられるよう今後も邁進してまいりたいと存じます。
井口 聖大1、室 龍之介2、呉羽 拓1、新田 剛2、高柳 広1
1東京大学大学院 医学系研究科 免疫学
2東京理科大学 生命医科学研究所 分子病態学部門

T細胞は多様なT細胞受容体(TCR)を一細胞あたり一つ発現すると広く知られているが、その一方で二つのTCRを発現する細胞が存在することを示唆する結果も報告されてきた。我々は新規マウスTCRαレポーターシステムを開発し、このような”デュアルTCRT細胞”を包括的に標識することに成功した。また、デュアルTCR T細胞を単離してシングルTCR T細胞との機能の比較を行ったところ、デュアルTCR T細胞がシングルTCR T細胞より高い抗腫瘍活性を有することを見出した。
本研究は、獲得免疫系の抗原特異性について再考する起点となり、また新規がんT細胞療法の開発に資することが期待される。
論文キーワード: T細胞受容体、対立遺伝子排除、抗腫瘍免疫
著者コメント:
この度はこのような栄誉ある賞をいただき、大変光栄に存じます。会期中は最先端の骨免疫学の知見に触れ、多くの先生方と交流し、美しい海に囲まれたブセナ岬で濃密な時間を過ごすことが出来ました。今回の経験を糧に、引き続き精進いたします。
豊田 仁志、細沼 雅弘、唐川 亜希子、小野 岳人、矢野 文子、高見 正道、工藤 理史
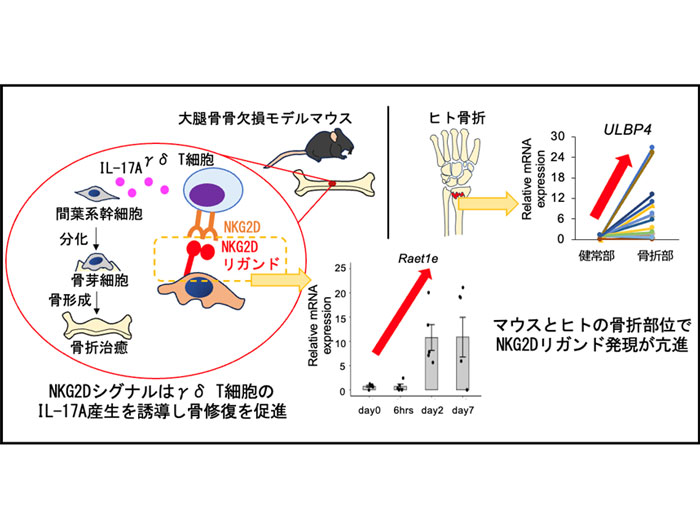
難治骨折では骨癒合不全や偽関節のリスクが高く、新規骨形成促進薬の開発が求められている。マウス骨修復においてγδ T細胞はIL-17Aを産生し骨形成を促進するが、その誘導機構は未解明である。本研究では、骨損傷に伴い誘導されるNKG2Dシグナルがγδ T細胞のIL-17A産生を介して骨形成を促進する可能性を検討した。骨欠損マウスではRAE-1発現が亢進し、γδ T細胞とIL-17A産生細胞はNKG2Dを発現していた。またモデルマウスへの抗NKG2D抗体の投与によりIL-17A遺伝子発現と骨形成が抑制されたことから、NKG2Dシグナルはγδ T細胞のIL-17A産生を介して骨形成を促進することが示唆された。さらにヒト骨折組織でもヒトNKG2DリガンドULBP4遺伝子の発現亢進を認め、マウス骨修復と同様のメカニズムが存在する可能性がある。
論文キーワード: 骨形成、γδ T細胞、NKG2D
著者コメント:
このたびは第10回日本骨免疫学会において最優秀演題賞という過分な評価を賜り、心より御礼申し上げます。骨修復におけるNKG2Dシグナルの意義という未踏のテーマに対し、多くの先生方からご指導とご助言をいただきながら取り組んできた成果です。今後も臨床応用を見据えた骨免疫研究に真摯に取り組んでまいります。



