
安藤 雄太郎1,2,3、塚崎 雅之4、山口 朗3、石原 和幸2,3、高柳 広1
1東京大学大学院 医学系研究科 免疫学
2東京歯科大学 微生物学講座
3東京歯科大学 口腔科学研究センター
4東京大学大学院 医学系研究科 骨免疫学寄附講座

生体内における厳密な石灰化制御機構の破綻によって生じる血管石灰化は、致命的な心血管イベントに繋がりやすく生命予後を顕著に増悪させる。しかし、その病態形成機序には未だ不明な点が多く、有効な治療法は確立されていない。破骨細胞分化誘導因子RANKLのデコイ受容体であるOPGは、血管石灰化の抑制因子として知られている。このOPGによる血管石灰化の制御メカニズムとして、骨芽細胞由来のOPGが破骨細胞の活性化を阻害することで血管石灰化発症を抑制する「カルシウムシフト説」が提唱されているが、生体レベルでは検証されていない。本研究では、RANKL/RANK/OPG系に着目し、血管石灰化発症の分子機構の解明を目指した。骨芽細胞特異的OPG欠損マウスでは、著しい骨量減少を認める一方で、血管石灰化の発症は稀であった。また、動脈硬化マウスモデルの病変部位のシングルセルRNA-seq解析データより、RANKL、RANK、OPGは血管を構成するストローマ細胞および病変部位に浸潤する免疫細胞において高発現することを見出した。さらに、血管構成細胞特異的にOPGを欠損させたマウスでは、骨量減少は認められない一方で、重度の血管石灰化を発症した。以上の結果は、OPGによる血管石灰化制御機構の定説「カルシウムシフト説」を覆しうるものであり、血管局所におけるRANKL/RANK/OPG軸の破綻が血管石灰化発症に寄与する可能性が示唆された。
論文キーワード:血管石灰化、OPG、異所性石灰化
著者コメント:
この度は、このような素晴らしい賞をいただき、心より感謝申し上げます。石垣の美しい夏空の下、全国から集まった多くの先生方との交流を通じて、骨代謝や免疫学の最新の知見を学ぶことができ、大変実りある学会となりました。今回の受賞を励みに、自身の研究をさらに発展させてゆきたいと思います。本研究にあたって、塚崎雅之先生をはじめ、ご指導いただきました多くの先生方に深くお礼申し上げます。
伊賀 隆史1,2,3、久保田 義顕1
1慶應義塾大学 解剖学教室
2慶應義塾大学 整形外科学教室
3佐野厚生病院 整形外科

骨の形成、修復過程において、血管が重要である事は知られているがその詳細な細胞・分子メカニズムは不明な点が多い。また近年、臓器毎の血管内皮細胞の遺伝子発現の違いが明らかにされ、血管内皮由来の組織形成因子(Angiocrine factor)の重要性が示唆されている。一般に骨折治癒力は年齢と共に低下することは広く知られているが血管をターゲットとした研究はなされていない。我々はマウスを用いた実験により、骨折時には、発生期の骨幹端で見られるTypeH血管が骨折部に誘導されるが、老齢マウスでは誘導されないことを見出した。さらにsingle-cell RNA sequencingを用いることにより、Angiocrine factorのうちのある一つの因子が骨折治癒に重要な役割を果たし、さらにその因子は老化と共に血管からの分泌量も低下し、骨折部に添加すると老齢マウスにおいても若いマウス同様の良好な骨折治癒をもたらすことを見出した。
論文キーワード:骨折、老化、血管内皮細胞
著者コメント:
この度はこのような素晴らしい賞を頂き、改めて感謝申し上げます。学会期間中は多くの研究者と交流を深めることができ、さまざまな分野の研究も知れ、何より大きな刺激を受けました。今後さらなる研究を続けていきたいと思います。
井口 聖大1、室 龍之介1、新田 剛1、高柳 広1
1東京大学 大学院医学系研究科 免疫学

“1つのT細胞は、T細胞受容体(TCR)を1種類のみを発現する。” この法則は免疫系の大原則とされてきた。しかしその一方で、2種類のTCRを発現するT細胞―デュアルTCR T細胞―の存在も確認されている。デュアルTCR T細胞と通常のシングルTCR T細胞を識別する手段がないことで、研究の進展が阻まれている現状を打開すべく、我々はアレル特異的なTCRα検出法の開発を目指した。
実際に、TCRα C領域遺伝子(Cα)の下流に対立遺伝子で異なるレポーターを挿入したマウスを作製したところ、レポーターの発現を指標に、デュアルTCR T細胞とシングルTCR T細胞を識別することに成功した。
た、このレポーターマウスのCα細胞外領域に対立遺伝子で異なるペプチドタグを挿入し、抗タグ抗体による細胞表面を行ったところ、デュアルTCR T細胞には”2つのTCRをどちらも細胞表面に発現している細胞”と“一方のTCRのみを細胞表面に発現している細胞”が存在することが明らかになった。
論文キーワード:T細胞受容体 (TCR)、遺伝子再編成、対立遺伝子排除
著者コメント:
この度は優秀演題賞にご採択いただき、誠にありがとうございます。夏の学術集会には今回が初めての参加でしたが、基礎から臨床まで幅広く、洗練された先生方の発表をお聴きし大変な刺激を受けました。本会を通じて多くの先生方から頂いた助言や激励を糧に、今後も精進して参ります。
Zhifeng He1、Toshihide Mizoguchi2、Toru Hiraga3、Yuko Nakamichi1、Shunsuke Uehara1、Linan Shi1、Ruoxuan Li1、Rina Iwamoto1、Takumi Takahashi1、Kohei Murakami4、Teruhito Yamashita1、Masanori Koide1、Nobuyuki Udagawa1&Yasuhiro Kobayashi1
1Institute for Oral Science,Department of Biochemistry,Matsumoto Dental University
2Oral Health Science Center,Tokyo Dental College
3Department of Oral Anatomy,Faculty of Dentistry,Matsumoto Dental University
4Faculty of Veterinary Medicine,Okayama University of Science

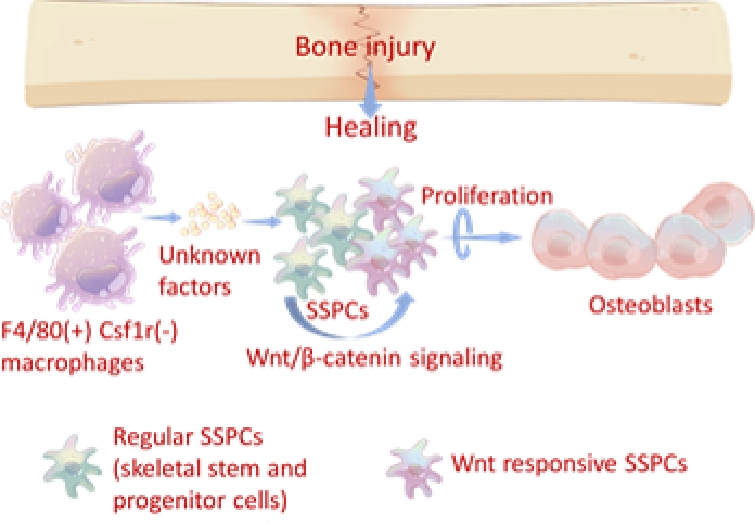
クロドロネートリポソーム(CloL) 投与によって、F4/80(+); Csf1r(+)とF4/80(+); Csf1r(-)Mφが顕著に枯渇した。これらのマウスの再生骨量は有意に減少した。一方、抗Csf1r Absの投与は、F4/80(+); Csf1r(+) Mφを枯渇させたものの、F4/80(+); Csf1r(-) Mφは正常であった。また、骨再生の遅延も認めなかった。この結果は、F4/80(+); Csf1r(-) Mφが骨再生に重要であることを示唆した。CloL投与は、増殖LepR(+)細胞も減少させた。さらに、Wntシグナルが活性化されたAxin2 tomato(+)細胞は、有意に減少した。【結論】F4/80(+); Csf1r(-)Mφは、間葉細胞を活性化し、骨や歯槽骨の再生を促進する。
論文キーワード:骨再生、マクロファージ、Wntシグナル
著者コメント:
本プロジェクトに際しましては、常にご指導、ご鞭撻を賜りました小林泰浩先生、宇田川信之先生に心より感謝申し上げます。松本歯大硬組織研究部門の先生方、同僚の皆様、多大なご協力をいただきありがとうございました。
岩本 莉奈1、高橋 拓実2、何 治鋒1、石田 昌義1、宇田川 信之1,3、小林 泰浩1
1松本歯科大学総合歯科医学研究所
2松本歯科大学大学院歯学独立研究科
3松本歯科大学歯学部生化学講座


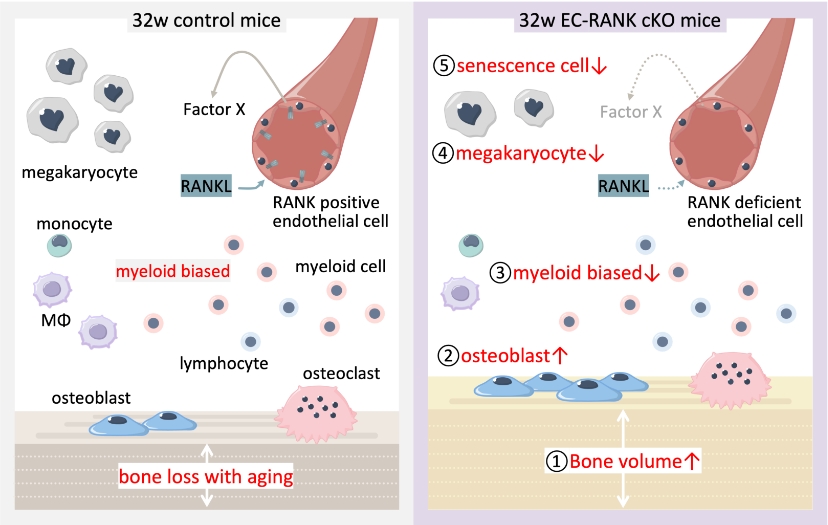
我々は、マウス骨髄におけるReceptor activator of NF-κB(RANK)発現細胞の系譜解析から、血管内皮細胞がRANKを発現し、さらに加齢に伴いRANK発現血管内皮細胞の割合が増加することを見出した。そこで、血管内皮細胞特異的RANK欠損(EC-RANK cKO)マウスを作出し、8-32週齢, 1年齢でμCT解析を行ったところ、32週齢及び1年齢EC-RANK cKOマウス骨量がcontrolマウスと比較して有意に増加していることが明らかになった。また、加齢に伴いミエロイド細胞分化偏向・巨核球増加を特徴とする骨髄老化が起こるが、32週齢EC-RANK cKOマウスにおいて骨髄老化が緩和されており、SA-β-gal陽性老化細胞が減少していることが明らかになった。これらの結果は、血管内皮細胞RANKが加齢に伴う骨量減少及び骨髄老化に寄与していることを示唆している。
論文キーワード:血管内皮細胞、RANK、老化
著者コメント:
この度はこのような栄誉ある賞を賜り、大変光栄に存じます。ポスター発表や受賞口演では多くの先生方からご質問及びご指摘をいただくことができ、大変勉強になりました。今後とも今回の学会テーマである「No challenge No Future」を掲げ、研究に邁進していきたいと思います。
宮原 潤也1、小俣 康徳2、寺島 明日香2、千々松 良太2、岡田 寛之3、鈴木 穣4、田中 栄1、齋藤 琢1
1東京大学大学院 医学系研究科 外科学専攻 感覚・運動機能医学講座 整形外科
2東京大学大学院 医学系研究科 外科学専攻 骨・軟骨再生医療講座
3東京大学大学院 医学系研究科 疾患生命工学センター
4東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻

本研究では膝OA患者の滑膜組織を組織染色、bulk/single cell RNA-seqで評価し、臨床情報、軟骨細胞のsingle cell RNA-seqデータを統合することで、特異的なサブセットとその機能を解析した。
滑膜組織のbulk RNA-seq・組織染色から膝OA滑膜は2つのタイプに分類され、Gene ontology解析の結果から炎症性/線維性滑膜と定義した。臨床スコアは疼痛を含め炎症性滑膜で悪い傾向が見られた。Single cell RNA-seqでは炎症性滑膜でCCLs,CXCLsを高発現するMerTKlowCD206lowマクロファージの割合が高く、線維性滑膜でBMPsやWNT阻害因子を高発現するCD34high線維芽細胞の割合が高いことが示された。滑膜細胞と軟骨細胞のデータを統合すると、CD34high線維芽細胞の軟骨細胞に対する保護的作用が示唆された。さらにCD34high線維芽細胞で高発現するCD70はT細胞増殖を促進し、ヒトOA軟骨組織と滑膜組織の共培養では抗CD70抗体投与により制御性T細胞減少と、ミエロイド系細胞のIL-1β産生増加が引き起こされ、qPCRでは滑膜組織の炎症性変化・軟骨組織の同化作用低下が見られた。
以上の結果からCD34high線維芽細胞が膝OAの滑膜炎を制御している可能性が示唆された。
論文キーワード:変形性膝関節症、滑膜炎、滑膜線維芽細胞
著者コメント:
この度は貴重な発表の機会を頂き、また優秀演題賞に選出して頂きましたこと、心より感謝申し上げます。また本学会は石垣島という素晴らしい環境で、多くの学びと交流の機会となりました。今回の受賞を糧に、今後も整形外科医の視点で医学・医療の発展に貢献して参ります。
金澤三四朗1、岡田寛之2、北條宏徳2,3、長村登紀子4、古村眞5、星和人1
1東京大学医学部附属病院 口腔顎顔面外科
2東京大学大学院医学系研究科 疾患生命工学センター 臨床医工学部門
3東京大学大学院工学系研究科 バイオエンジニアリング専攻
4東京大学医科学研究所 附属病院セルプロセッシング・輸血部
5東京大学医学部附属病院 組織幹細胞・生命歯科学

手術と再建を繰り返す口唇口蓋裂(CL/P)の新たな治療技術革新は大きな課題であるが、CL/P発生における遺伝子発現調節メカニズムを解明が解決の糸口になる可能性がある。本研究では、臍帯が胎児と母体に共通した特性を有する唯一の組織であることに着眼し、発生過程で生じる特性変化を捕捉可能であると考え、CL/P由来臍帯細胞を用いてscRNA-seq解析を行った。遺伝子発現プロファイルを基に細胞集団の特定と機能的背景を割り出し、trajectoryの描出による集団の分化プロセスおよび機能的特性を解析した。その結果、CL/Pが健常組織と比較して、明らかな特性の違いを示唆した。次に、先行で実施されたゲノムワイド関連解析(GWAS)で特定された臍帯血CL/P関連因子が、本研究で検出したCL/P関連因子と一致することが明らかになり、CL/P発症に強く関与することを示唆した。したがって、本研究で特定した因子を検証し応用することで、出生前診断あるいは胎児治療が可能となると期待される。
キーワード:口唇口蓋裂、single cell transcriptomics、再生医療
著者コメント:
急激な少子化にともない、先天性疾患の発症自体も減少することから、近い将来、稀少疾患化していくだろうと推測します。そのときを迎える前に本研究を昇華させ、胎児治療という新たな治療法として臨床導入できればと期待します。なお本研究の成果はとくに、検体を供与していただいた長村登紀子先生と、岡田寛之先生の革新的なST解析技術なくして得られませんでした。この場をもって深謝申し上げます。
後藤 愛佳1、高橋 秀侑1、吉田 良知1、板宮 孝紘1,2、中野 正博3、石垣 和慶3、太田 峰人1、岡村 僚久1,2、藤尾 圭志1
1東京大学大学院医学系研究科 アレルギー・リウマチ学
2東京大学大学院医学系研究科 免疫疾患機能ゲノム学講座
3理化学研究所 生命医科学研究センター ヒト免疫遺伝研究チーム

自己免疫疾患患者の免疫担当細胞に関する機能ゲノムデータベースImmuNexUT (Ota et al., Cell, 2021)構築時に、加齢で増加する新規のCD4陽性T細胞サブセット”Age-associated helper T cells: ThA細胞“を同定し、機能解析や臨床情報との関連解析を行った。ThA細胞は自己免疫疾患患者の末梢血中でも増加し、健常人由来のThA細胞に比してCXCL13、IL21を特徴的に発現し、B細胞の抗体産生誘導能を発揮した。特に全身性エリテマトーデスにおいては、ThA細胞の遺伝子発現変動と疾患活動性との強い関連を認め、病態形成への寄与が示唆された。さらに、ThA細胞のCXCL13発現を制御する重要な遺伝子まで同定した。ThA細胞の制御機構の更なる解析は、SLEを含む自己免疫疾患の病態解明や新規創薬の可能性を内包する。
論文キーワード:Aging、B cell helper function、Autoimmune diseases
著者コメント:
この度は優秀演題賞にご選出いただき、大変光栄に存じます。そして本研究についてご指導・ご協力いただいた先生方に心よりお礼を申し上げます。石垣島の絶景とともに、様々な分野の先生方と楽しくディスカッションができ、大変貴重な機会でした。今後さらに研究内容を発展させるべく努力してまいりたいと思います。
小又 尉広1、立花 秀介2、相崎 良美3、三村 俊英3、佐藤 浩二郎1
1自治医科大学医学部内科学講座アレルギー膠原病学部門
2公立阿伎留医療センターリウマチ科
3埼玉医科大学リウマチ膠原病科
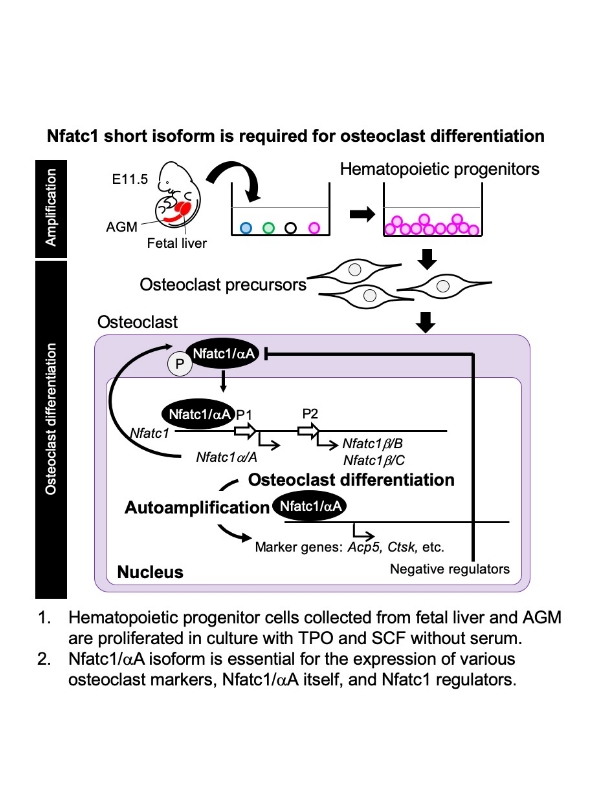
転写因子Nuclear Factor of Activated T cell 1 (Nfatc1)は、破骨細胞分化のマスター遺伝子であるが、6種類のアイソフォームが存在する。mRNA発現レベルをqPCRおよびRNA-seqにより解析すると、short form(Nfatc1/αA)が最も高い発現を示した。
Nfatc1/αAノックアウトマウスをゲノム編集により作製し、Nfatc1/αAが破骨細胞分化に必須であることを示した。さらに、qPCRおよびGene Chipによる遺伝子発現解析より、RANKLにより発現が増加し、かつNfatc1/αA欠損により発現が減少する遺伝子を同定した。本研究により、Nfatc1/αAは自身の発現を増幅すること、Nfatc1/αAは破骨細胞分化を促進する遺伝子および抑制する遺伝子の発現を制御し、破骨細胞分化を調節していることを示した。
キーワード:Nfatc1 short isoform、破骨細胞、血球前駆細胞
著者コメント:
この度は、研究発表の機会をいただきありがとうございました。ゲノム編集により、Nfatc1アイソフォームのうち、Nfatc1/αAのみ欠損したノックアウトマウスを作出しました。しかしながら、胚性致死であったため、E11.5胚から血球系前駆細胞を回収して、破骨細胞を分化誘導する培養法を確立しました。
竹上 陽菜1、福永 鷹信2、山本 正道3、西川 恵三1
1同志社大学大学院 生命医科学研究科
2九州大学大学院 工学研究院
3国立循環器病研究センター

オステオサイトは、骨の力覚を担う主たる細胞と考えられていますが、これはin vitroからの知見を根拠としているために、生体骨組織内でオステオサイトが本当に力覚に関わるかは不明な点が多いのが現状でした。そこで、本研究では、生きたマウスの骨組織に対して力学的負荷をかけた状態で、骨組織内のオステオサイトのライブイメージングに取り組みました。まず最初に、脛骨の形状にフィットする固定具を3Dプリンタで独自に作出することで、力学的負荷を加えた条件下でも、脛骨内の同一視野を観察する二光子励起顕微鏡法を確立しました。続いて、メカノメディエーターであるATPに着目し、ATPを蛍光可視化するFRET型バイオセンサーをオステオサイトで発現するマウスの系統を用いることで、オステオサイトの生体骨組織内における力覚応答の実体を明らかにしました。
以上の研究によって、従来研究では見出されていないオステオサイトの力覚応答の一端を見出すことに成功しました。
キーワード:オステオサイト、二光子励起顕微鏡、ライブイメージング
著者コメント:
この度は優秀演題に選出いただき、感謝申し上げます。学会では多くの先生から貴重な助言をいただいたことや非常にレベルの高い講演や討論から学んだ経験を糧にして今後も研究に励んでまいりたいと思います。
中村 和貴1,2、塚崎 雅之3、星 和人2、高柳 広1
1東京大学 大学院医学系研究科 免疫学
2東京大学大学院医学系研究科 外科学専攻 感覚・運動機能医学講座 口腔顎顔面外 科学
3東京大学 大学院医学系研究科 骨免疫学寄付講座

頭頸部扁平上皮がん(HNSCC)は世界で6番目に頻度の高い悪性腫瘍であり、年間45万人の命を奪っている。HNSCCは上顎骨や下顎骨などの骨組織に直接浸潤することが特徴であり、骨浸潤は患者の生命予後を顕著に増悪する。様々な腫瘍において、原発巣からの血行性骨転移のメカニズムが精力的に研究されている一方、骨浸潤は腫瘍が骨組織へと浸潤する過程に「骨膜」が介在する点で一般的な骨転移とは異なる病態形成機序が想定されるが、腫瘍骨浸潤の実験系はこれまでヒト細胞株と免疫不全マウスを用いたものしかなく、その分子機構や生体応答機序に関し不明な点が多く残されている。本研究において我々は、B6系統マウスにおけるHNSCC骨浸潤モデルを世界ではじめて確立し、浸潤部組織を用いたシングルセルRNAseq解析をおこなうことで、腫瘍の骨組織への接近に伴い骨膜細胞の数が増加すること、骨膜細胞において遺伝子発現パターンが大きく変化することを明らかにした。腫瘍浸潤前の骨膜細胞ではプロテアーゼ阻害因子PIFの発現が上昇しており、PIF欠損マウスではHNSCC骨浸潤が著名に増悪した。以上より、骨膜は腫瘍の接近に応じて肥厚することで物理バリアを形成すると同時に、PIFを放出することで骨浸潤を抑制することが明らかとなり、骨組織は腫瘍に対するユニークな生体防御機構を有している可能性が示唆された。
キーワード:頭頸部扁平上皮癌、骨浸潤、骨膜
著者コメント:
本研究は、高柳広教授と塚崎雅之特任助教のご指導の下おこなったものです。また、ラボのメンバーや共同研究者の方々にも多大なるサポートを頂きました。この場を借りて厚く御礼申し上げます。
研究成果を社会に還元するため、さらに努力を重ねて参ります。
Yuya Shirai1-3、Yoshimitsu Nakanishi2,4-6、Akari Suzuki7、Hachiro Konaka8、Rika Nishikawa9、Kyuto Sonehara1、Shinichi Namba1、Hiroaki Tanaka10、Tatsuo Masuda11,12、Mayuko Izumi2、Yumiko Mizuno2、Takayuki Morisaki13,14、Yoichiro Kamatani15、Shingo Nakayamada10、Chikako Nishigori9、Yoshiya Tanaka10、Yoshito Takeda2、Kazuhiko Yamamoto7、Atsushi Kumanogoh2,4,5,16、Yukinori Okada1,3,16-18
1Department of Statistical Genetics, Osaka University Graduate School of Medicine, Suita, Japan.
2Department of Respiratory Medicine and Clinical Immunology, Osaka University Graduate School of Medicine, Suita, Japan.
3Laboratory of Statistical Immunology, Immunology Frontier Research Center (WPI-IFReC), Osaka University, Suita, Japan.
4Department of Immunopathology, Immunology Frontier Research Center (WPI-IFReC), Osaka University, Suita, Japan.
5Integrated Frontier Research for Medical Science Division, Institute for Open and Transdisciplinary Research Initiatives (OTRI), Osaka University, Suita, Japan.
6Department of Advanced Clinical and Translational Immunology, Osaka University Graduate School of Medicine, Suita, Japan.
7Laboratory for Autoimmune Diseases, RIKEN Center for Integrative Medical Sciences, Yokohama, Japan.
8Department of Respiratory Medicine and Clinical Immunology, Public Interest Incorporated Foundation, Nippon Life Saiseikai, Nippon Life Hospital, Osaka, Japan.
9Division of Dermatology, Department of Internal Related, Kobe University Graduate School of Medicine, Kobe, Japan.
10The First Department of Internal Medicine, University of Occupational and Environmental Health, School of Medicine, Fukuoka, Japan.
11Department of Obstetrics and Gynecology, Osaka University Graduate School of Medicine, Suita, Japan.
12StemRIM Institute of Regeneration-Inducing Medicine, Osaka University, Suita, Japan.
13Division of Molecular Pathology, Institute of Medical Sciences, University of Tokyo, Tokyo, Japan.
14Department of Internal Medicine, Institute of Medical Science, University of Tokyo Hospital, Tokyo, Japan.
15Laboratory of Complex Trait Genomics, Department of Computational Biology and Medical Sciences, Graduate School of Frontier Sciences, The University of Tokyo, Tokyo, Japan.
16Center for Infectious Diseases for Education and Research (CiDER), Osaka University, Suita, Japan.
17Laboratory for Systems Genetics, RIKEN Center for Integrative Medical Sciences, Yokohama, Japan.
18Department of Genome Informatics, Graduate School of Medicine, the University of Tokyo, Japan.

本研究では、バイオバンク・ジャパン(日本)・UKバイオバンク(英国)などにより収集された84万人のヒトゲノム解析を行い、自己免疫疾患(関節リウマチ、バセドウ病、1型糖尿病)、アレルギー疾患(気管支喘息、アトピー性皮膚炎、花粉症)の遺伝的背景を明らかにした。両群はゲノム情報から、「自己免疫疾患は疾患リスクがHLA遺伝子領域に集中している」、「アレルギー疾患は疾患リスクがサイトカイン遺伝子領域に偏ってゲノム上に散在している」という2群に分類することができた。一方、本研究では両群に共通した効果を示す遺伝子多型を4か所同定した。機能的な解釈として、これらの遺伝子多型が免疫に関わる遺伝子の発現量を変化させることで疾患リスクに影響している可能性を示した。本研究は免疫系の異常とヒトゲノムの関連の解明に寄与し、疾患間で共通する遺伝子は免疫系の制御因子として、マルチターゲットの創薬標的となる可能性が期待される。
キーワード:ゲノムワイド関連解析(GWAS)、自己免疫疾患、アレルギー疾患
著者コメント:
この度は優秀演題賞に選出していただき、また研究紹介をさせていただき感謝申し上げます。本研究は、ゲノム・臨床データを提供していただいた方、解析・実験をご指導いただいた方の多大なご協力のおかげで完成しました。本研究にご協力いただいた全ての方に感謝を申し上げます。
有馬 嵩博1、本間 風花1、宮本 健史1
1熊本大学整形外科学講座

Enpp1(Ectonucleotide pyrophosphatase/phosphodiesterase 1)は石灰化の強力な抑制因子であるピロリン酸の主要な生成因子であり、その変異により異所性石灰化や骨粗鬆症などの病態の原因となることが知られています。Enpp1は様々な部位での発現が報告されていますが、どの臓器で骨代謝・リン代謝を制御するのかどうかは不明となっております。本研究ではEnpp1-EGFP-luciferaseノックインマウスを用いて解析を行い、軟骨細胞で特異的に発現していることを発見しました。また軟骨細胞特異的なEnpp1ノックアウトマウスを樹立し、同マウスがEnpp1の全身的なノックアウトマウスの表現型の一部を再現することを発見しました。この結果より、Enpp1が軟骨細胞で全身的な骨代謝・リン代謝を制御していることが示唆されました。本研究がEnpp1の解析の一助となれば幸いです。
キーワード:Enpp1(Ectonucleotide pyrophosphatase/phosphodiesterase 1)、老化、異所性石灰化
著者コメント:
熊本大学大学院生命化学研究部整形外科学講座の有馬と申します。この度は優秀演題賞を賜り、誠にありがとうございます。今後も精進して参ります。
吉村 直人1、本間 風花1、宮本 健史1
1熊本大学整形外科学講座




